2026-01-04
近日,浙江工商大学食品与生物工程学院顾青教授团队在国际顶级期刊《Advanced Materials》(影响因子26.8)上发表了题为《Calcium-powered probiotics reconfigure the intestinal niche via biofilm transformation》的研究论文,提出一种基于“钙武装益生菌”的肠道菌膜转换新策略,为肠道致病菌感染及相关疾病治疗提供了创新性解决方案。浙江工商大学是该论文的唯一通讯单位,顾青教授为通讯作者,李永璐副研究员为第一作者。

研究指出,超过90%的肠炎患者肠道内可检测到侵袭性菌膜的存在。浮游致病菌可通过鞭毛、菌毛等附属物相互交联附着,产生自诱导信号激活菌膜特异性基因表达,分泌胞外多糖等黏附因子促进菌体聚集、稳定群落结构,最终形成菌膜。成熟的菌膜产生糖化酶,释放顶端细菌扩散并形成新菌膜,从而不断占据肠道生态位。致病菌膜的强势生态占位竞争性抑制共生菌群的生长、降解黏液层组分、改变肠腔微环境、干扰肠上皮细胞能量供给,造成肠道菌群、黏液层及上皮细胞多界面的严重失衡,触发肠炎、代谢综合征、神经退行性、自身免疫性及癌症等肠内外疾病。脱硫弧菌通过直接黏附封闭O-聚糖表位抗原,竞争性占据定殖位点;同时还原粘蛋白间二硫键降解糖基化,削减定殖位点数量;此外,它还产生硫化氢,阻碍丁酸盐β-氧化,抑制肠上皮细胞L型钙通路引起钙流入不足,从而阻滞粘蛋白的分泌,限制受损黏液层的重塑以干扰新生定殖位点的补充,最终导致益生菌定殖抗性,呈现“一过性”。
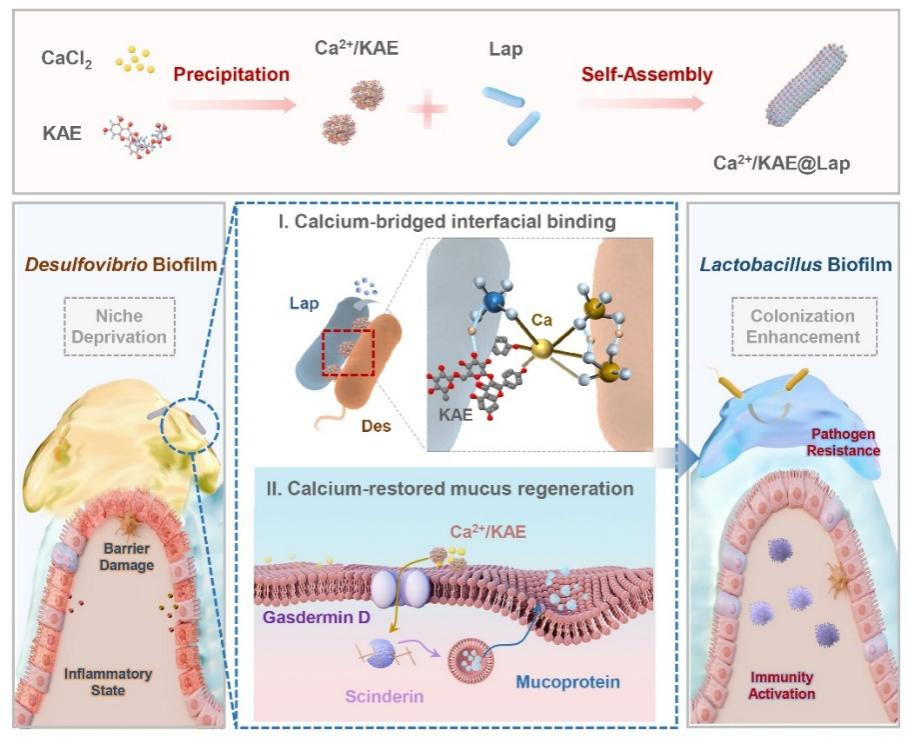
重构肠道生态位是清除脱硫弧菌菌膜并实现益生菌定植的必要条件,需要有针对性地增强微生物-宿主的串扰,以占据现有的生态位并重塑代谢微环境,以产生新的生态位。顾青教授团队设计构建了一种瞄准定植位点抢占与重塑的菌膜转换策略。利用钙离子(Ca2+)和天然钙调节成分KAE对脱硫弧菌拮抗型乳酸杆菌(Lap)进行修饰(Ca2+/KAE@Lap),与传统仅选择黏附性生物聚合物或小分子以增强益生菌与宿主肠道组分互作的策略相比,这种修饰的益生菌系统利用了钙介导的双重肠道机制:一方面,Ca2+作为阳离子介质,能够与脱硫弧菌菌膜阴离子官能团及乳酸杆菌表面配体间形成离子及配位键,这种Ca2+依赖性桥接强烈增强了脱硫弧菌-乳酸杆菌的结合亲和力,从而能够靶向杀伤脱硫弧菌及释放生态位。另一方面,KAE激活肠上皮细胞上的钙通道,促进Ca2+内流以抵消脱硫弧菌引起的钙抑制,从而恢复依赖钙的黏液层重塑,并补充减少的结合位点。这一钙驱动的“原位替代-黏液层重塑”行为,能够有效转换肠道脱硫弧菌菌膜为乳酸菌菌膜,实现益生菌的稳定定植。
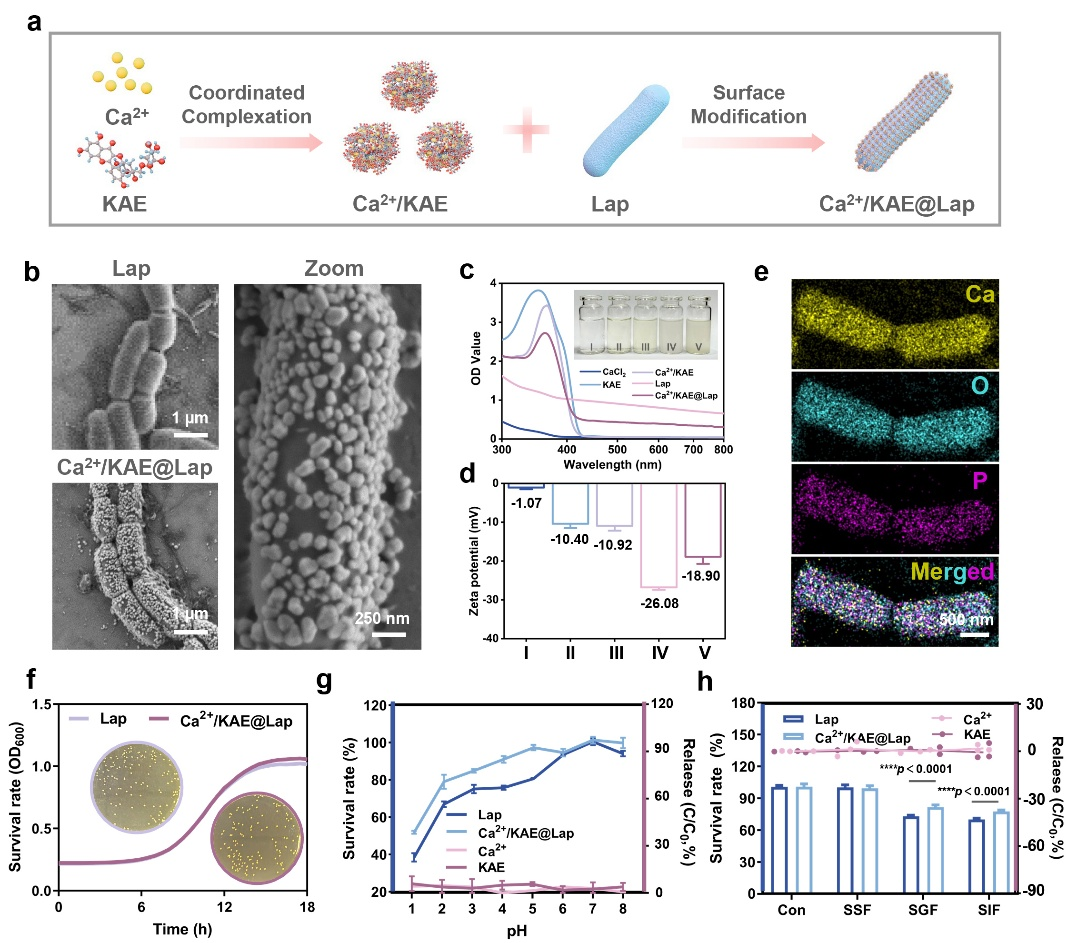
Ca2+/KAE@Lap的设计与构建
Ca2+/KAE@Lap在秀丽隐杆线虫及小鼠等多种生物模型中被证实具有显著的菌膜转换能力。通过靶向杀灭致病菌并重塑利于益生菌定植的微环境,成功实现从脱硫弧菌主导的菌膜向植物乳杆菌富集的菌膜转化,从而促进益生菌的长期肠道定植,并显著缓解急性结肠炎症状。此外,Ca2+/KAE@Lap能够经由MHC-I类抗原呈递通路激活免疫应答,通过经典配体H2-K1/D1激活CD8⁺ T细胞,以及通过非经典分子H2-Q6/Q7激活γδ T细胞。该免疫激活机制与益生菌菌膜物理屏障协同作用,共同抵御脱硫弧菌的再次侵袭,最终实现肠道微生态长期稳态的维持。
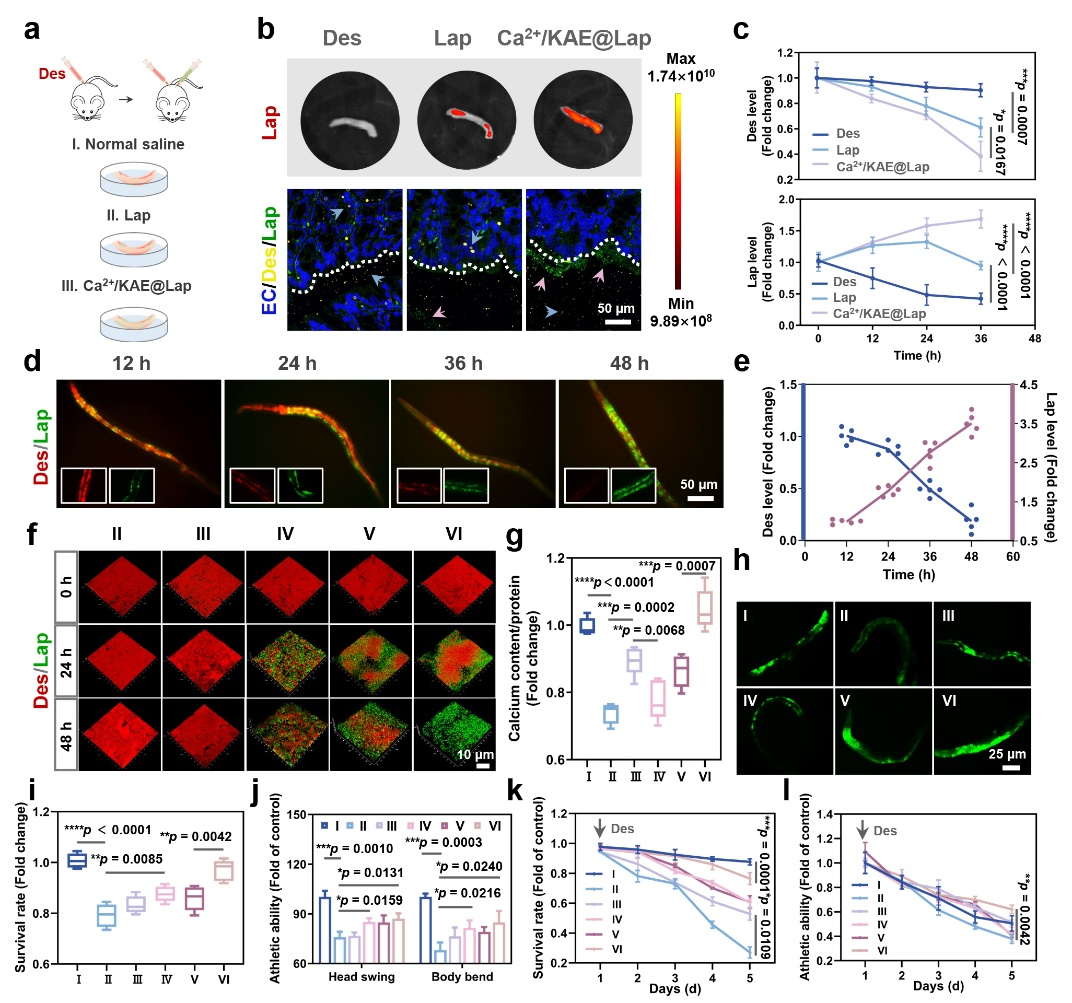
Ca2+/KAE@Lap的多模型菌膜转换效应验证
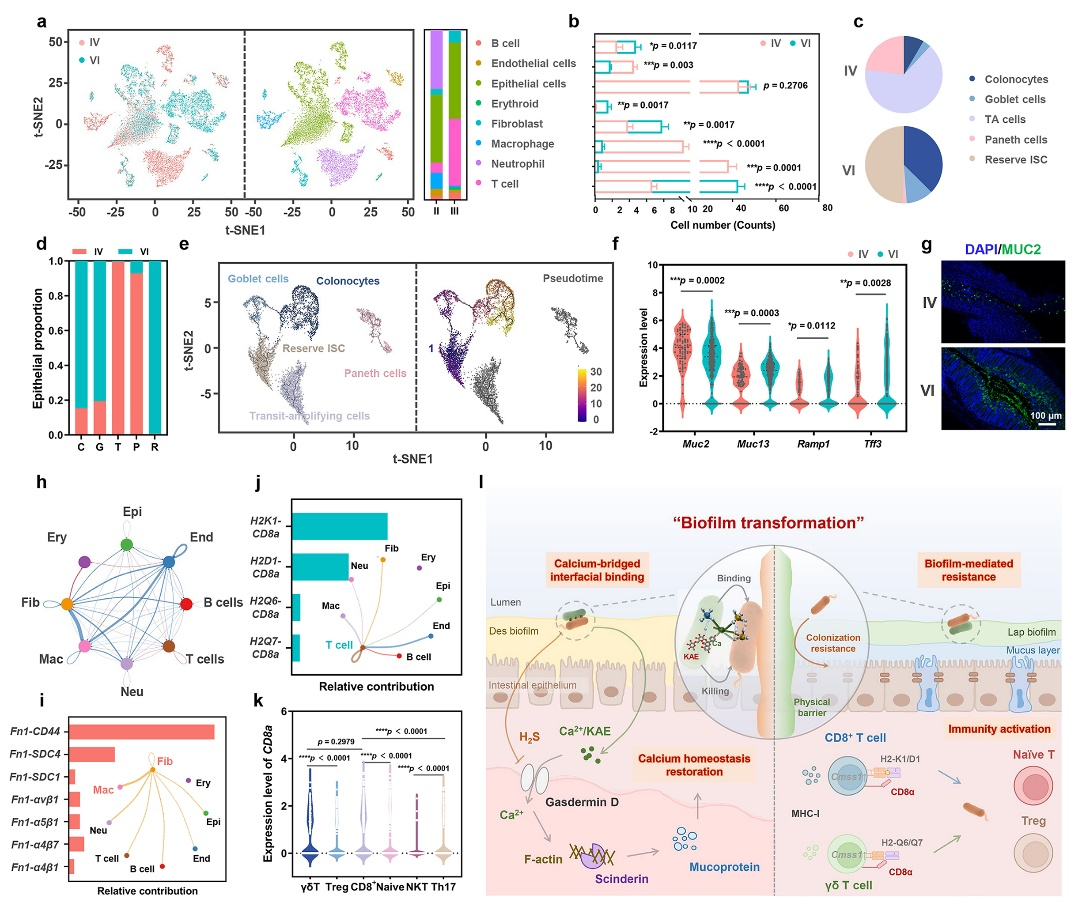
Ca2+/KAE@Lap介导的“物理-免疫”双重屏障构建以抵御致病菌再攻击
论文信息:Li, Y., Yan, S., Song, H. et al. Calcium-Powered Probiotics Reconfigure the Intestinal Niche via Biofilm Transformation. Advanced Materials, 2025. DOI: 10.1002/adma.202516911.